Ist es eine Pflanze? Ist es ein Tier? Nein, es ist ein Pilz!
Ist es eine Pflanze? Ist es ein Tier? Nein, es ist ein Pilz!
Pilze bilden eine Gruppe ganz für sich, auch wenn viele denken, es seien Pflanzen. Manchmal sind Pilze nett und helfen im Waldboden bei der Zersetzung von totem Material, womit dem natürlichen Kreislauf wieder Nährstoffe zugeführt werden. Oft aber haben sie es auf die totale Herrschaft abgesehen. Sie dringen in Pflanzen und Tiere ein und toben sich dort aus – nicht selten ohne Rücksicht auf das Leben ihres Wirtes. So gibt es eine parasitische Pilzart, die Insekten zu willenlosen Zombies macht. Einige Pilze wachsen sogar in Menschen.
Pilze, das sind doch die lustigen Dinger mit Stiel und Hut, die romantisch im Wald rumstehen und deren Daseinszweck darin besteht, von Touristen in knallbunten Regenjacken in die Pfanne gehauen zu werden, oder? Ähm, nein. Pilze sind oft miese kleine Parasiten, die nur sich selbst dienen. Und in den seltensten Fällen sind sie so freundlich, sich als Abendessen zu eignen. Aber fangen wir erst einmal mit den nützlichen Pilzen an.
Geneigte Pilzsammler werden wissen, dass bestimmte Pilze bevorzugt unter ausgesuchten Bäumen wachsen – der Birkenpilz unter Birken, der Steinpilz unter anderem in der Nähe von Fichten, und so weiter. Das liegt an einer uralten Partnerschaft zwischen Pflanzen und Pilzen, der sogenannten „Mykorrhiza“. Das Wort setzt sich zusammen aus den griechischen Wörtern mykos (Pilz) und rhiza (Wurzel). Dabei geht eine Pilzart eine unterirdische Verbindung mit der Pflanzenwurzel ein. Aber nicht nur Bäume haben solche Pilzpartner – etwa 80 % aller Landpflanzen haben so eine Mykorrhiza. Doch wozu brauchen Pflanzen Pilze – und umgekehrt?
Eine Mykorrhiza ist eine sogenannte Symbiose, eine enge Partnerschaft zwischen zwei unterschiedlichen Lebewesen, die beiden Vorteile bringt. Die Pflanze erhält vom Pilz Mineralstoffe wie Stickstoff und Phosphor, die im Boden in Verbindungen vorliegen, die nur der Pilz aufschließen und verarbeiten kann. Im Gegenzug erhält der Pilz von der Pflanze Nährstoffe in Form von Zuckern. Wie tauschen die beiden sich aus? Nun, Pilze bestehen nicht nur aus einem Stiel und einem Hut, ganz im Gegenteil. Dieser Teil beherbergt lediglich die Fortpflanzungsorgane. Das ist richtig, wir essen die Geschlechtsorgane von Pilzen. (Kriegt euch wieder ein, es schreit ja auch keiner „Iiiiih, Geschlechtsorgane!“, wenn er eine Blume sieht.) Der eigentliche „Körper“ des Pilzes ist ein weit verzweigtes unterirdisches Netz von sehr, sehr dünnen Fäden, für das bloße Auge praktisch unsichtbar. Dieses Netz heißt „Myzel“ (das spricht man „Mühzeel“), ein einzelner Faden ist eine „Hyphe“ (das wird wie „Hüfe“ ausgesprochen).
Die Hyphen wachsen unter der Erde vor sich hin, bis sie auf eine geeignete Pflanzenwurzel treffen. Die Pflanze sendet sogar chemische Stoffe aus, um die Pilzhyphen anzulocken. Hat eine Hyphe Kontakt zu einer Wurzel aufgenommen, bildet sie eine spezielle Struktur, mit der sie sich durch die Außenwand der Wurzel bohrt. Dazu kann die Hyphe an der Kontaktstelle einen unglaublich hohen Druck aufbauen. Experimente habe gezeigt, dass dieser Druck bis zu 100 bar betragen kann. Zum Vergleich: In einem Autoreifen herrscht ein Luftdruck von 2 bis 2,5 bar, ein richtig  knallhart aufgepumpter Rennradreifen kann es schon mal auf 10 bar bringen. Immer noch kein Vergleich zum Pilz! Der baut diesen Druck jedoch nur an einem mikroskopisch kleinen Punkt auf. Das reicht aber locker, um sich in die Pflanzenwurzel zu bohren. Zusätzlich sind außerdem Enzyme im Einsatz, die die Zellwände der Pflanzenwurzel ein bisschen durchlässiger machen. Die Hyphe wächst dann innerhalb der Zellen der Pflanzenwurzel und bildet dort stark verzweigte Strukturen. Dadurch haben Pilzhyphe und Pflanzenzellen eine große Oberfläche zur Verfügung, über die sie nun die besagten Stoffe austauschen können. So brutal der ganze Vorgang klingt, die Pflanze nimmt den Pilz bereitwillig auf, sie organisiert sogar die Zellen um, in die der Pilz vorgedrungen ist, um das Meiste aus der Partnerschaft zu machen.
knallhart aufgepumpter Rennradreifen kann es schon mal auf 10 bar bringen. Immer noch kein Vergleich zum Pilz! Der baut diesen Druck jedoch nur an einem mikroskopisch kleinen Punkt auf. Das reicht aber locker, um sich in die Pflanzenwurzel zu bohren. Zusätzlich sind außerdem Enzyme im Einsatz, die die Zellwände der Pflanzenwurzel ein bisschen durchlässiger machen. Die Hyphe wächst dann innerhalb der Zellen der Pflanzenwurzel und bildet dort stark verzweigte Strukturen. Dadurch haben Pilzhyphe und Pflanzenzellen eine große Oberfläche zur Verfügung, über die sie nun die besagten Stoffe austauschen können. So brutal der ganze Vorgang klingt, die Pflanze nimmt den Pilz bereitwillig auf, sie organisiert sogar die Zellen um, in die der Pilz vorgedrungen ist, um das Meiste aus der Partnerschaft zu machen.
Klingt doch alles ganz toll, oder? Der Pilz tut der Pflanze doch einen Gefallen? Jein. So bereitwillig die Pflanze ihre äußeren Wurzelzellen für den Pilz einrichtet, so sehr muss sie Strukturen weiter innen vor ihm schützen. In der Mitte der Pflanzenwurzel liegt der sogenannte Zentralzylinder, durch den die Pflanze Wasser und Nährstoffe
transportiert – quasi die Blutbahn der Pflanzen. In die würde der Pilz zu gerne eindringen, um direkt an die Zuckerlösung zu kommen, die ihm die Pflanze im Rahmen der Mykorrhiza nur rationiert zukommen lässt. Doch dagegen wehrt sich die Pflanze, indem sie Lignin, den „Holzstoff“, in die Zellen einlagert, die den Zentralzylinder umgeben. Damit weist die Pflanze den Pilz in seine Schranken und erhält die Partnerschaft halbwegs freundlich und zum gegenseitigen Nutzen.
Doch das Lignin schützt nicht vor allen Pilzen! Eine Pflanze geht nämlich nicht nur mit einem Pilz so eine Verbindung ein, sondern meist mit mehreren. Genauso interagiert ein- und derselbe Pilz mit mehreren Pflanzenpartnern. Die beiden führen also eine sehr, sehr offene Beziehung. Der Vorteil davon: Die Mykorrhiza vernetzt mehrere Pflanzen miteinander, die so auch untereinander kommunizieren und Stoffe austauschen können. Außerdem kann die Pflanze von den unterschiedlichen Eigenschaften verschiedener Pilze profitieren (und umgekehrt). Der Nachteil: Pilze, die es gar nicht so gut meinen, können sich unter den echten Symbiosepartnern einschleichen. Die nehmen genauso Kontakt auf wie die „guten“ Pilzpartner, saugen dann aber schamlos Zucker aus der Pflanze, ohne etwas dafür zurückzugeben. Noch schlimmere Zeitgenossen unter den Pilzen tun ebenfalls so, als wollten sie eine Mykorrhiza bilden, wachsen dann aber tief in die Wurzel und schaffen es, in den Zentralzylinder vorzudringen, von wo aus sie sich in der gesamten Pflanzen verbreiten, diese von innen durchwuchern und förmlich auffressen. Nett, oder? Immerhin gibt es einige Pflanzen, die ein bisschen Rache nehmen: Sie bilden Mykorrhizzen und lassen sich gemütlich mit Mineralstoffen beliefern, knausern aber kräftig mit dem Zucker. Einige Orchideenarten sind da gut drin. Ein bisschen Gerechtigkeit muss sein.
Verlassen wir das Pflanzenreich und begeben uns zu den Tieren (darauf habt ihr doch nur gewartet!). Wenn man „Pilze“ hört, denkt man meist erstmal an Basidiomyzeten. Woran bitte? Ok, das Wort „Basidiomyzeten“ (zu Deutsch „Ständerpilze“ – haha, ich weiß) kommt wohl nur Wenigen in den Sinn. Eher hat man ein Bild von einem netten Pilz zwischen Moos und Laub vor Augen, vielleicht sitzt da noch ein Heinzelmännchen drauf. So ein Pilz ist, wie schon erwähnt, das Fortpflanzungsorgan, der sogenannte „Fruchtkörper“ eines Basidiomyzeten. Es gibt aber noch massenhaft andere Pilzarten, die nicht diese uns wohlbekannten Fruchtkörper bilden. Die haben entweder ganz anders aussehende oder gar keine spezialisierten Fruchtkörper. Das unterirdische Myzel-Netzwerk ist ihnen aber fast allen gemein. Doch lange nicht jeder Pilz ist so freundlich, sein Myzel friedlich im Waldboden zu bilden. Manche wachsen innerhalb von Insekten. Oder Menschen.
Da hätten wir zum Beispiel Ophiocordyceps unilateralis, eine parasitische Pilzart, deren Sporen auf den Panzern von Ameisen auskeimen und dann in den Körper der Ameise hineinwachsen. Dort befällt der Pilz das Nervensystem der Ameise und manipuliert ihr Verhalten. Die Ameise hört auf, für ihre Kolonie zu arbeiten und macht sich stattdessen auf den Weg zu einem Blatt oder der Baumrinde – sie wird zum willenlosen Zombie, der nur noch dem Pilz dient. Bei Blatt oder Rinde angekommen, beißt die Ameise sich fest und stirbt. Der Pilz bildet nun einen keulenförmigen Fruchtkörper, der aus dem Hirn der Ameise herauswächst wie eine kleine Antenne. In dem untenstehenden Video, einem Ausschnitt aus der englischen BBC-Serie Planet Earth, seht ihr das Ganze in Echt. Ophiocordyceps unilateralis hat mit dieser gruseligen Fortpflanzungsstrategie schon Computerspiele und Science-Fiction-Romane inspiriert.
Zombie-Ameisen sind schon ein bisschen gruselig, aber irgendwie auch faszinierend. Wenn so ein Pilz allerdings in uns Menschen wächst, hört der Spaß auf. Ausgerechnet ein Vertreter der Hefepilze kann uns mächtig zu schaffen machen. Ein bestimmter Hefepilz, die Bierhefe, auch Bäckerhefe genannt, ist dem Menschen seit Jahrtausenden zu Diensten. Auch in der Wissenschaft wird dieser Hefepilz sehr verbreitet genutzt. Auf Schlau heißt diese Pilzart Saccharomyces cerevisiae. Gebäck und Gesöff – wer wollte ohne sie leben? Allerdings findet man selbst im Weißbier keine Myzel-Netzwerke, höchstens ein bisschen pudrigen Bodensatz. Das liegt daran, dass Hefepilze oft kein Myzel bilden, sondern als einzelne, winzige Pilzzellen durch die Gegend schwimmen. Auch Nicht-Hefepilze (wie die erwähnten Ständerpilze) bilden in manchen Lebensstadien einzelne Zellen, die dann zu Ehren der einzelligen Hefen als „Hefestadium“ oder „Hefeform“ bezeichnet werden.
Doch bei Weitem nicht alle Hefen finden ihre Erfüllung darin, uns Menschen mit Gebäck und Gesöff zu versorgen. Ein ziemlich gemeiner Vertreter der Hefepilze ist die Gattung Candida, vor allem die Art Candida albicans. Und ich habe eine schlechte Nachricht: Diesen Pilz tragen etwa 70 bis 75 Prozent von uns in sich. Die gute Nachricht: Meistens ist er harmlos. Meistens.
Candida albicans lebt bei gesunden Menschen im Darm und auf Schleimhäuten im Gleichgewicht mit all den anderen Mikroorganismen, die sich dort tummeln, etwa Milchsäurebakterien. Gerät das Gleichgewicht aber aus der Balance, kann der Pilz die Überhand bekommen und zu einer Erkrankung werden. Das kann etwa passieren, wenn man eine Antibiotikatherapie macht. Dabei werden nämlich nicht nur die krankmachenden Bakterien abgetötet, sondern alle Bakterien, die man im Körper trägt, auch die guten. Darauf hat der Pilz gewartet – die Milchsäurebakterien, die mit ihm um Platz und Nahrung konkurrieren, sind weg, und los geht’s mit der Pilzinfektion! Candida kann im Prinzip den ganzen Körper befallen, häufig sind die Mundhöhle (das nennt man dann „Soor“) und der weibliche Genitalbereich.
ACHTUNG! Das heißt NICHT, dass Antibiotikatherapien automatisch schlecht sind! Oft sind sie die letzte Rettung, denn auch Bakterieninfektionen können sehr gefährlich sein für Leib und Leben! Wenn ihr Antibiotika verschrieben bekommt, nehmt IMMER die ganze Packung bis zum Ende, genau, wie eure Ärztin oder euer Arzt es verschrieben hat! Auch, wenn es euch schon eher besser geht. Sonst züchtet ihr multiresistente Bakterien in eurem Körper, die ihr womöglich nie wieder loswerdet! (Ok, der Belehrungsmodus geht jetzt wieder aus)
Ein Tip für die Mädels: Wenn ihr wisst, dass ihr während einer Antibiotikakur zu Scheidenpilz neigt, kauft in der Apotheke Milchsäurezäpfchen (ja, für die Mumu). Die helfen dabei, die Scheidenflora bakterienfreundlich zu halten und können so einer Pilzinfektion entgegenwirken.
Solche oberflächlichen Pilzinfektionen sind trotzdem noch vergleichsweise harmlos und meist gut zu behandeln. Candida ist allerdings auch dazu in der Lage, in die Blutbahn vorzudringen und von da aus den gesamten Körper von innen zu befallen. Daran kann man sterben. Das passiert unter normalen Umständen nicht oft. Wer ab und zu Fußpilz hat, muss also keine Angst haben. In Krankenhäusern ist Candida allerdings oftmals ein Problem, da vor allem sehr geschwächte Personen anfällig sind für so eine systemische Pilzinfektion – Candida steht inzwischen auf Platz vier der gefährlichsten Krankenhauskeime.
Jetzt muss ich die Behlerungskeule doch noch mal rausholen: Solltet ihr eine Pilzinfektion haben, probiert bitte nicht mit Hausmitteln oder Homöopathie herum, sondern geht sofort zum Arzt. Der wird euch antimykotische Arzneimittel verschreiben, die den Pilz meist innerhalb weniger Tage ausmerzen. So lange kann selbst der überzeugteste Anhänger des Paläo-Lifestyles ein paar künstlich hergestellte chemische Stoffe aushalten. Je länger der Pilz wuchert, desto höher ist nämlich die Wahrscheinlichkeit, dass er doch seinen Weg in die Blutbahn findet. Und dann geht man wirklich ganz authentisch den Weg des ach-so-natürlich lebenden Höhlenmenschen, der seinerzeit an heutzutage völlig harmlosen Infektionen meist starb.
Wir Menschen können leider wenig nutzen aus Pilzen ziehen, die in unseren Körper eindringen, so wie Pflanzen das können. Wir können nur über das Pilzreich triumphieren, indem wir einige seiner Vertreter aufessen.

 Als ob es nicht schon genug Artikel, Dokufilme, Blogs und Diskussionsrunden über die “richtige” Ernährung gäbe. Es sind abnorm viele. Und alle behaupten etwas anderes. Wie soll man da noch ruhigen Gewissens essen? Kann man nicht, habe ich festgestellt. Doch ich habe eine wunderbar einfache Lösung gefunden, mit der ich persönlich sehr gut klarkomme: Ignorieren. Einfach alles ignorieren.
Als ob es nicht schon genug Artikel, Dokufilme, Blogs und Diskussionsrunden über die “richtige” Ernährung gäbe. Es sind abnorm viele. Und alle behaupten etwas anderes. Wie soll man da noch ruhigen Gewissens essen? Kann man nicht, habe ich festgestellt. Doch ich habe eine wunderbar einfache Lösung gefunden, mit der ich persönlich sehr gut klarkomme: Ignorieren. Einfach alles ignorieren.

 Die Verkündung der Nobelpreise 2016 ist durch. Dieses Jahr wurden Forschungsthemen geehrt, die die Menschheit vielleicht nicht viel, aber doch ein bisschen weiterbringen – solide und skandalfrei. Das war schon mal anders. Hier sind ein paar Erkenntnisse und Menschen, deren Auszeichnung mit dem wichtigsten Wissenschaftspreis inzwischen umstritten ist.
Die Verkündung der Nobelpreise 2016 ist durch. Dieses Jahr wurden Forschungsthemen geehrt, die die Menschheit vielleicht nicht viel, aber doch ein bisschen weiterbringen – solide und skandalfrei. Das war schon mal anders. Hier sind ein paar Erkenntnisse und Menschen, deren Auszeichnung mit dem wichtigsten Wissenschaftspreis inzwischen umstritten ist.

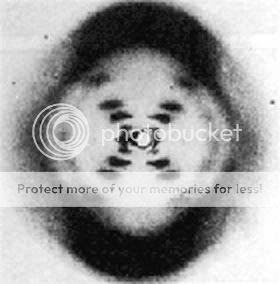
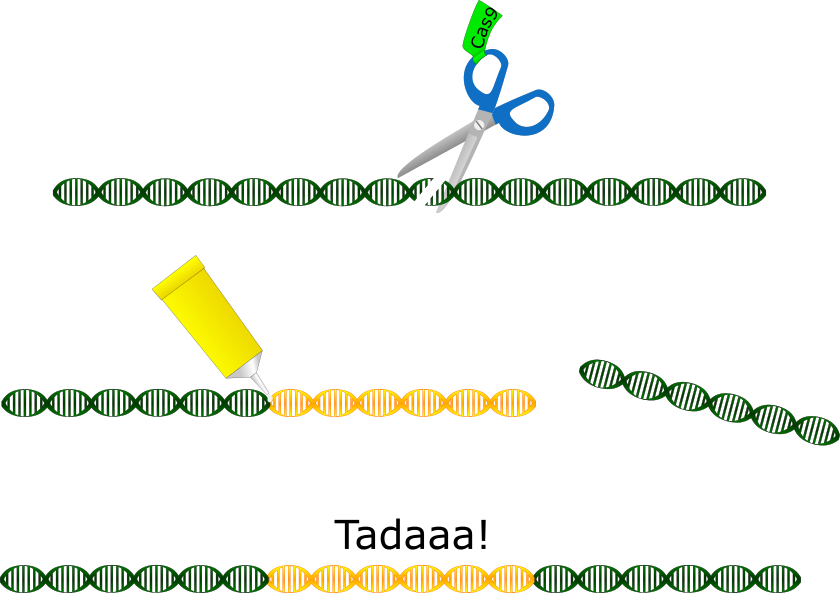 Morgen wird verkündet, wer den Nobelpreis für Chemie bekommt. Und CRISPR-Cas9, die “Genschere” steht ganz hoch im Kurs. Aber was hat es damit auf sich – und warum verdient die Technik einen Nobelpreis?
Morgen wird verkündet, wer den Nobelpreis für Chemie bekommt. Und CRISPR-Cas9, die “Genschere” steht ganz hoch im Kurs. Aber was hat es damit auf sich – und warum verdient die Technik einen Nobelpreis?
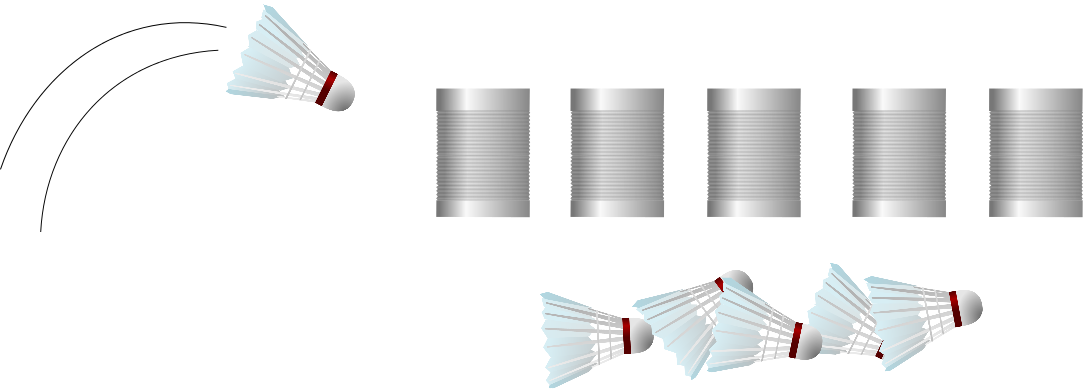






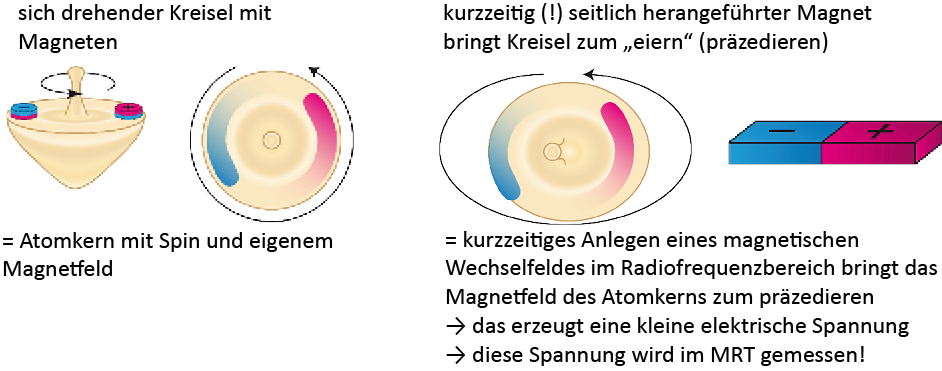
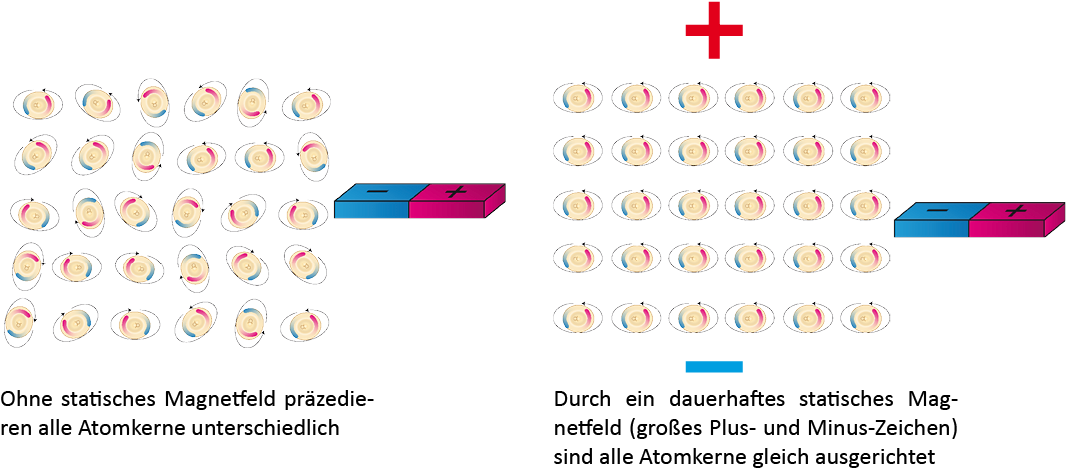
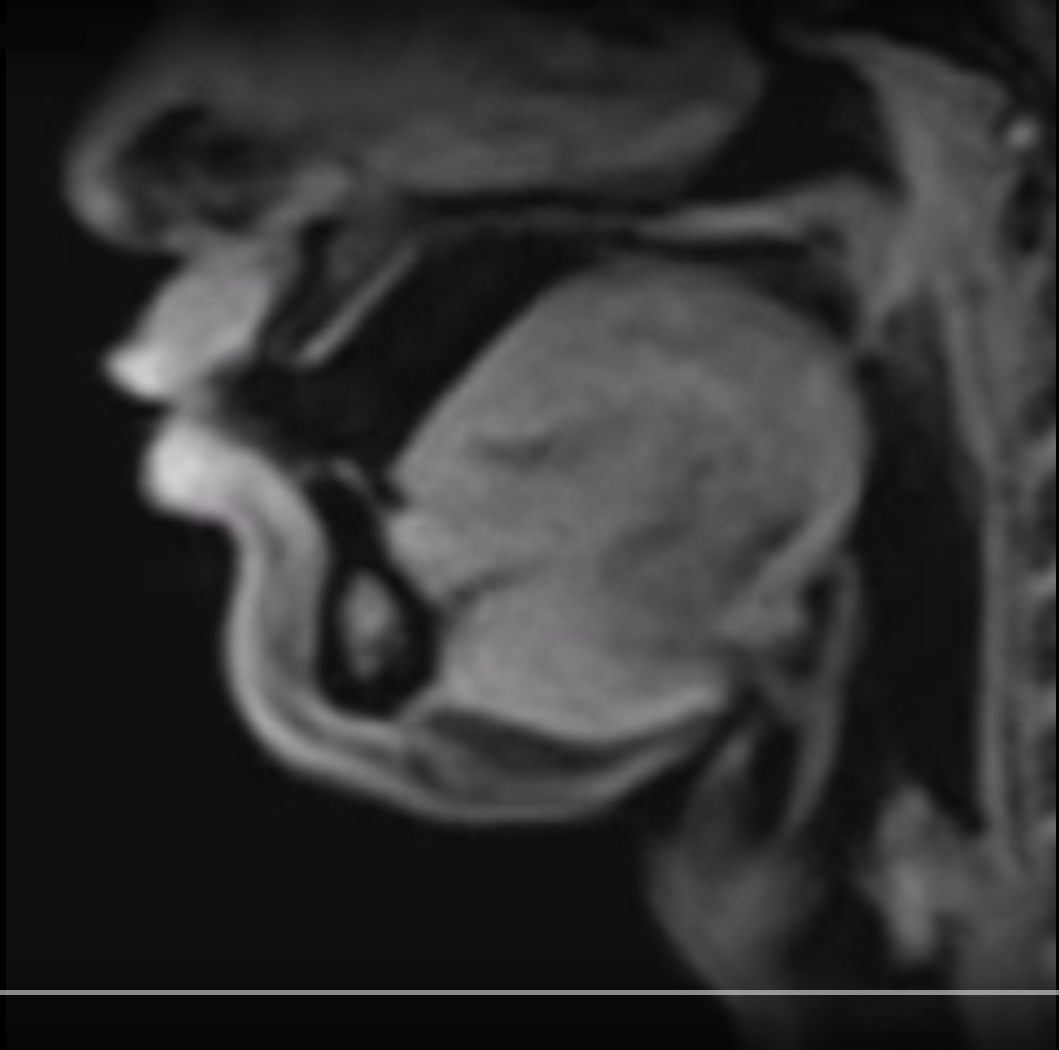 Die Abkürzung “MRT” hat jeder bestimmt schonmal gehört. Die drei Buchstaben stehen für das Wort “Magnetresonanztomografie”.Bei einem Magnetresonanztomografen handelt es sich um eine der berüchtigten “Röhren”, in die man geschoben wird, wenn die Ärzte nicht so richtig wissen, was man hat. Anders als die Computertomografie – auch so eine “Röhre” im Krankenhaus – arbeitet die MRT nicht mit eventuell schädlicher Röntgenstrahlung, sondern mit Magnetfeldern. In der folgenden Box könnt ihr nachlesen, wie MRT funktioniert.
Die Abkürzung “MRT” hat jeder bestimmt schonmal gehört. Die drei Buchstaben stehen für das Wort “Magnetresonanztomografie”.Bei einem Magnetresonanztomografen handelt es sich um eine der berüchtigten “Röhren”, in die man geschoben wird, wenn die Ärzte nicht so richtig wissen, was man hat. Anders als die Computertomografie – auch so eine “Röhre” im Krankenhaus – arbeitet die MRT nicht mit eventuell schädlicher Röntgenstrahlung, sondern mit Magnetfeldern. In der folgenden Box könnt ihr nachlesen, wie MRT funktioniert.