 Morgen wird verkündet, wer den Nobelpreis für Chemie bekommt. Und CRISPR-Cas9, die “Genschere” steht ganz hoch im Kurs. Aber was hat es damit auf sich – und warum verdient die Technik einen Nobelpreis?
Morgen wird verkündet, wer den Nobelpreis für Chemie bekommt. Und CRISPR-Cas9, die “Genschere” steht ganz hoch im Kurs. Aber was hat es damit auf sich – und warum verdient die Technik einen Nobelpreis?
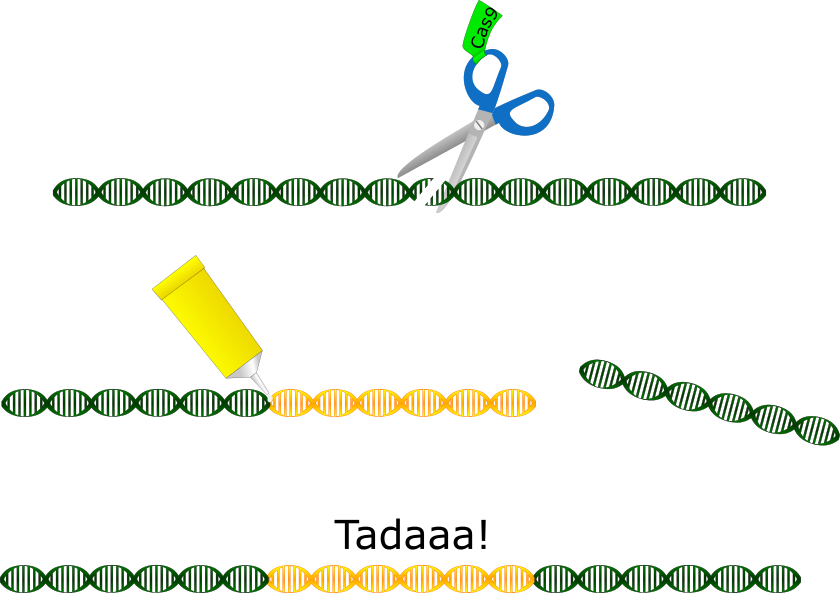
Mit CRISPR-Cas9 können Wissenschaftler erstmals ganz gezielt und mit hoher Erfolgsrate Mutationen herstellen. Warum wollen wir das? Beim Wort “Mutation” denkt man ja meist erstmal an Monster oder die X-Men oder sowas. Mutationen sind aber meist ganz unspektulär: Es sind schlichtweg Veränderungen in Genen, die mal gute, mal schlechte, mal gar keine Effekte auf den Körper haben. Ist ein Gen mutiert, so funktioniert das Protein, dessen Bauplan in dem Gen gespeichert ist, nämlich möglicherweise anders oder gar nicht mehr. Im Labor macht man sich darum Mutationen zu Nutze, um die Funktion eines Gens herauszufinden. Man schaltet das Gen also aus und schaut dann, was im Organismus nicht mehr funktioniert. Daraus kann man dann Rückschlüsse auf die Funktion des Gens und des von ihm codierten Proteins schließen. Im Prinzip kann man sich diese Vorgehensweise vorstellen wie eine Maschine, bei der man ein Teil ausbaut und dann guckt, was an der Maschine nicht mehr funktioniert.
Gene sind allerdings ziemlich klein und darum sehr schwierig “auszubauen”. In der Vergangenheit war das ein größeres Problem – es war praktisch unmöglich, ein bestimmtes Gen gezielt auszuschalten. Begeben wir uns also auf eine kleine Zeitreise:
Ab den 1920er Jahren – die Schrotschuss-Methode

Damals haben Wissenschaftler Zellen mit mutagenen (=Mutationen erzeugenden) Chemikalien oder UV-Licht behandelt und gehofft, dass dabei ein interessantes Gen beschädigt wird. Das ist so ähnlich, als ob man aus einer Dosenpyramide genau eine Dose herausschießen will, aber leider nur ein Schrotgewehr zur Verfügung hat. Dementsprechend dauerte es oft Jahre, ehe man eine interessante Mutation erzeugt hatte. Es ging aber auch gar nicht anders, denn man wusste damals noch nicht, welche oder wieviele Gene das Lebewesen, mit dem man da als Wissenschaftler arbeitete, überhaupt hatte. Von der vollständigen DNA-Sequenz des Lebewesens konnte man nur träumen – die Struktur der DNA war ja nicht einmal bekannt. Man wusste gerade eben, dass Gene existierten und dass sie erbliche Eigenschaften von Lebewesen bestimmen. Das wars. Wenn man also die Dosenpyramide nicht sieht, kann man eben einfach nur in die ungefähre Richtung schießen und das beste hoffen.
Ab den 1980er Jahren – der Federball
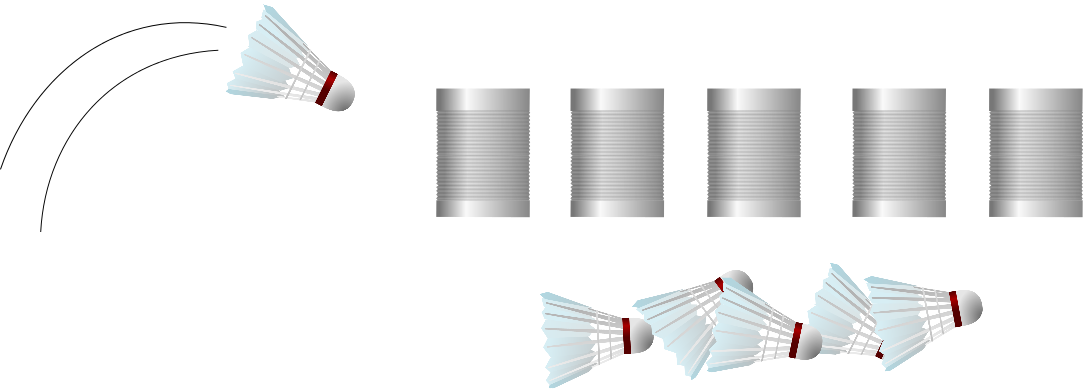
Später konnte man dann etwas gezielter vorgehen, mithilfe der “homologen Rekombination”, die funktioniert so (siehe auch Abbildung weiter unten): Forscher stellen ein relativ kurzes Stück DNA her, das dem Gen, das sie mutieren wollen, vollkommen gleicht – mit einem wichtigen Unterschied: Es enthält die Mutation, die die Forscher in dem gewünschten Gen erzeugen wollen. Entscheidend sind die sogenannten “Homologie-Arme”. Dort ist die Sequenz der hergestellten DNA exakt dieselbe wie im ursprünglichen (“Wildtyp”-)Gen, das sich in der DNA der Zelle oder des Lebewesens befindet, das die Wissenschaftler erforschen. So kann man also ganz gezielt entscheiden, wo die Mutation stattfinden und wie sie aussehen soll. Die hergestellte DNA mit der gewünschten Mutation bringen die Forscher nun in die Zelle oder das Lebewesen ein. Mit den Homologie-Armen kann die hinzugefügte DNA in die Wildtyp-DNA eindringen und einen der beiden ursprünglichen DNA-Stränge verdrängen. Der Vorgang heißt dementsprechend auch “Strang-Invasion”. Der verdrängte, ursprüngliche Strang wird abgebaut und der noch vorhandene Wildtyp-Strang wird so verändert, dass er nun zu dem mutierten Strang passt. Voilà, die Mutante ist perfekt.

Wenn es denn klappen würde. Dass der hergestellte Strang tatsächlich in die Wildtyp-DNA eindringt, ist nicht gesagt. Wenn man richtig viel Glück hat, klappt es nach 200 Versuchen – mit Pech allerdings erst nach 100.000 Versuchen. Warum ich es “Federball” nenne? Mit einem Federball kann man ziemlich gezielt auf eine bestimmte Dose werfen, aber der Federball ist auch so leicht, dass er die Dose oftmals nicht umschmeißt.
Seit 2015: Das High-Tech-Präzisionsgewehr

Nun gibt es endlich eine Lösung für fast alle Mutagenese-Probleme: CRISPR-Cas9. Und das hat sich die Natur ganz alleine ausgedacht. Es ist eigentlich das “Immunsystem” bestimmter Bakterien. Die erkennen eindringende Viren und haben ein Enzym, nämlich Cas9, mit dem sie die DNA des Eindringlings kurzerhand zerschneiden. Wie erkennen sie den Eindringling? Dafür gibt es bestimmte kurze RNAs in den Bakterienzellen, die dieselbe Sequenz habe wie die DNA des Virus. Die kurze RNA lagert sich an die Viren-DNA an. Sie hat außerdem ein “Schwänzchen”, das dann Cas9 anlockt. Schließlich schneidet Cas9 die von der kurzen RNA markierte Viren-DNA einfach kaputt. Aufgrund ihrer Eigenschaft, Cas9 zu seinem Einsatzort zu leiten, wurde diese RNA “short guide RNA”, kurz sgRNA genannt. Und dieses System aus sgRNA und DNA-Schneideenzym hat man schlichtweg für die Anwendung im Labor angepasst. Die sgRNA kann man so gestalten, das sie eine beliebige, genau definierte Stelle in der DNA jedes beliebigen Lebewesens erkennt und Cas9 dorthin dirigiert. Cas9 schneidet dann dort die DNA kaputt. Darauf reagiert die Zelle, indem sie die DNA repariert, allerdings fast immer ungenau. Bei dieser Reparatur werden entweder ein paar Basenpaare der DNA gelöscht oder einige hinzugefügt – es entsteht also eine Mutation genau da, wo man sie haben will. Im Idealfall mit einer Erfolgsrate von 100 %. Doch CRISPR-Cas9 kann noch mehr: Es erhöht die Erfolgsrate der homologen Rekombination nämlich extrem. Die Zelle ist viel eher geneigt, eine von außen zugegebene DNA einzubauen, wenn die entsprechenden Stelle in der Wildtyp-DNA kaputt ist. So kann man die DNA also gezielt aufschneiden und der Zelle auch gleich eine Vorlage für die Reparatur anbieten, die sie meist dankbar annimmt. Auf diese Weise kann man lange DNA-Abschnitte, sogar ganz neue Gene in Zellen einbringen.
Die Anwendungsmöglichkeiten sind gewaltig – im Labor lassen sich die Aufgaben von Genen und Proteinen viel schneller erforschen und in der Biotechnolgie kann man Bakterien genetisch so verändern, dass sie noch effizienter wichtige Stoffe wie Insulin herstellen. Eines Tages können wir die Technik vielleicht sogar in der Gentherapie einsetzen, um Krebs und andere Krankheiten zu heilen. Doch auch die Kehrseite muss man betrachten – wenn die Technik extrem viel weiterentwickelt wird, könnte man damit eines Tages Dinge genetisch verändern, die nicht unbedingt notwendig sind. Kritiker fürchten, dass wir bald “Designerbabys” herstellen. Dafür wissen wir aber noch viel, viel zu wenig darüber, wie unsere DNA funktioniert, das ist also sicherlich ferne Zukunftsmusik.
Nicht ganz so fern ist die Verkündung des Nobelpreisses – morgen wissen wir mehr. Dann wird vielleicht die spannende Frage beantwortet, wen das Nobelkommittee für die wichtigsten Wegbereiter von CRISPR-Cas9 hält, über diese Frage flogen nämlich in den letzten Monaten die Fetzen. Ich bin gespannt.
