Die Verkündung der Nobelpreise 2016 ist durch. Dieses Jahr wurden Forschungsthemen geehrt, die die Menschheit vielleicht nicht viel, aber doch ein bisschen weiterbringen – solide und skandalfrei. Das war schon mal anders. Hier sind ein paar Erkenntnisse und Menschen, deren Auszeichnung mit dem wichtigsten Wissenschaftspreis inzwischen umstritten ist.
Die Verkündung der Nobelpreise 2016 ist durch. Dieses Jahr wurden Forschungsthemen geehrt, die die Menschheit vielleicht nicht viel, aber doch ein bisschen weiterbringen – solide und skandalfrei. Das war schon mal anders. Hier sind ein paar Erkenntnisse und Menschen, deren Auszeichnung mit dem wichtigsten Wissenschaftspreis inzwischen umstritten ist.
Es gab zum Beispiel einige Nobelpreise für Erkenntnisse, die sich später als falsch herausstellten. Johannes Fibiger etwa gewann 1926 für die Entdeckung des winzigen parasitischen Rundwurmes Spiroptera carcinoma, der laut Fibiger Krebs auslöste. In seinen Experimenten fütterte er Ratten mit Kakerlaken, die mit dem Wurm infiziert waren. Die Ratten entwickelten Darmtumore. Wie sich später herausstellte, war daran aber nicht direkt der Parasit Schuld – die Ratten litten aufgrund des einseitigen Futters an einem Vitamin A-Mangel, der die Darmzellen extrem empfindlich machte. Der Parasit reizte die Zellen dann so sehr, dass sie sich zu Krebszellen entwickelten – jeder Reiz hätte also Krebs ausgelöst. Der Wurm wurde inzwischen umbenannt in Gongylonema neoplasticum. Fibiger war aber nicht komplett auf dem Holzweg – es gibt durchaus parasitische Würmer, die Krebs verursachen können. Fibiger ist übrigens ironischerweise an Darmkrebs gestorben.

Manchmal wurden auch Dinge geehrt, die heutzutage ethisch gar nicht mehr gehen. 1949 erhielt António Egas Moniz den Nobelpreis für die Technik der präfrontalen Leukotomie. Dabei wurden die Nervenverbindungen getrennt, die den präfrontalen Kortex an den Rest des Gehirns koppeln. Das sollte Menschen mit schweren psychiatrischen Erkrankungen wie manischer Depression oder Schizophrenie heilen. Wenn man bedenkt, dass es damals keine Medikamente gegen psychische Störungen gab, kann man es noch nachvollziehen, dass solche Operationen durchgeführt wurden. Es gibt tatsächlich einige Fälle, in denen die Leukotomie das Befinden des Patienten deutlich besserte. Moniz nutzte als Testobjekte allerdings Frauen in einem „Irrenhaus“, wie es damals noch hieß, in Lissabon. Die hatten keine Chance, die Operation abzulehnen, sie wurden vermutlich nicht wirklich gefragt. Der präfrontale Kortex ist unter anderem zuständig für die emotionale Bewertung der Umwelt – nicht verwunderlich also, dass die Patienten nach der OP zu emotionalen Zombies wurden. Fraglich ist auch, ob die Leukotomie immer notwendig war. Sie wurde in großem Stil an „hysterischen“ Frauen, Homosexuellen und sogar Kindern durchgeführt. Der jüngste Patient war 12 Jahre alt. Seine Stiefmutter wollte, dass er eine Leukotomie erhielt, da er sich manchmal weigerte, ins Bett zu gehen und öfter tagträumte.

Ein häufiges Symptom männlicher Nobelpreisträger – und des Nobelpreiskommittees – ist die fröhliche Ignoranz gegenüber Frauen, die die mit dem Preis ausgezeichnete Arbeit wesentlich vorangebracht haben. Joshua Lederberg beispielsweise erhielt den Nobelpreis für seine Entdeckungen von Viren, die Bakterienzellen infizieren. Solche Viren nennt man „Phagen“, und der von Lederberg entdeckte erhielt den Namen „Lambda“ (λ) – und Lederberg den Nobelpreis. Blöd nur, dass seine Frau Esther Lederberg den Phagen eigentlich entdeckt, erstmals isoliert und beschrieben hatte. Joshua aber bekam dafür den Nobelpreis und erwähnte seine Frau genau einmal in seiner Nobelpreisvorlesung. (In der deutschen Wikipedia gibt es nicht einmal einen Artikel über Esther Lederberg!)

James Watson und Francis Crick, die 1962 gemeinsam mit Maurice Wilkins den Nobelpreis für die Aufklärung der Doppelhelix-Struktur der DNA bekamen, drückten sich komplett darum, ihre Kollegin Rosalind Franklin zu erwähnen. Sie hatte die Experimente entwickelt und durchgeführt, die letztlich die Aufklärung der DNA-Struktur zur Folge hatten. Anhand dieser Daten hatte sie selbst die Struktur beinahe vollständig aufgeklärt. Watson und Crick hatten wohl ohne Franklins Wissen Einsicht in ihre Ergebnisse. In ihrer Nobelpreisrede erwähnten die Herren Rosalind Franklin gar nicht. James Watson wunderte sich in seiner Erzählung „Die Doppelhelix“ nur darüber, dass Franklin sich so unweiblich kleidete und kein Make-Up benutzte. Naja, derselbe Typ hat ein paar Jahrzehnte später einige extrem fragwürdige Aussagen über den Zusammenhang zwischen Rasse und Intelligenz gemacht und dann seine Nobelpreismedaille verkauft, weil er im Zuge des politischen Skandals seinen Job verloren hatte.
Vielleicht hat das Nobelpreiskomitee darum dieses Jahr nur Erkenntnisse geehrt, die schon einige Jahrzehnte alt sind. Da ist die Wahrscheinlichkeit gering, dass sich über die ausgezeichneten Arbeiten jetzt noch jemand aufregt. Nummer Sicher.

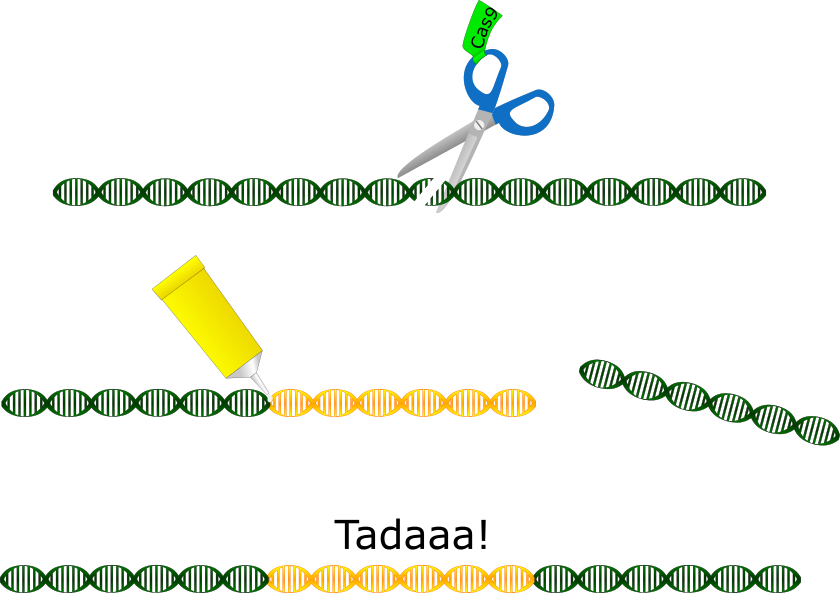 Morgen wird verkündet, wer den Nobelpreis für Chemie bekommt. Und CRISPR-Cas9, die “Genschere” steht ganz hoch im Kurs. Aber was hat es damit auf sich – und warum verdient die Technik einen Nobelpreis?
Morgen wird verkündet, wer den Nobelpreis für Chemie bekommt. Und CRISPR-Cas9, die “Genschere” steht ganz hoch im Kurs. Aber was hat es damit auf sich – und warum verdient die Technik einen Nobelpreis?